절제 불가능한 담관암 환자에 대한 고주파 온열치료와 화학 요법 병용으로 호전된 사례보고
대전대학교 천안한방병원 류주영, 대전대학교 천안한방병원 이강욱, 대전대학교 천안한방병원 조창묵, 원광대 전주한방병원 주종천, 대전대학교 천안한방병원 이남훈, 대전대학교 둔산한방병원 유화승
2017년 7월 26일
초록
암세포를 가열시키고 항암제 및 방사선 요법과의 시너지 효과를 내는 비침습적 치료법인 고주파온열치료는 암 환자에게 유망한 치료법으로 부상하고 있다. 이 연구의 목적은 절제 불가능한 담관암 환자의 치료를 위해 적용된 화학 요법(시스플라틴/젬시타빈)과 고열 치료의 병용치료 사례를 보고하는 것이다.
54세 남자 환자가 간문부 담관암(담관종양)으로 진단 받고 화학 요법으로 비조영성 및 수술 전 방사선 치료를 받았다. 그러나 방사선 치료와 화학 요법으로 치료가 성공적이지 않았기 때문에 두 번째 치료 방법으로 화학 요법과 병용한 고열 치료를 받기로 결정했다.
그는 피로, 소화 불량, 상복부 통증 및 황달로 고통 받고 있었다. 화학 요법과 병행된 고열은 4개월에 걸쳐 32회 시행되었다. 환자는 중대한 합병증을 경험하지 않았고 환자의 상태는 호전되었고 탄수화물 항원 19-9(CA 19-9)와 총 빌리루빈 수치는 상대적으로 낮아졌다. 또한, 컴퓨터 단층 촬영 검사에서 담관암이 진행되지 않았음을 보여주었다. 결론적으로, 이 증례보고는 화학 요법과 병용한 고주파 온열 치료가 절제 불가능한 담관암 환자에게 유망한 치료법이 될 수 있음을 시사한다.
키워드
화학 요법 , 담관암 , 고주파온열치료 , 담관종양 , 고주파
소개
담관암은 희귀 악성 종양으로 간내 또는 외 간 외의 담도계를 통해 발생할 수 있다. 담관암은 간내, 근위부 또는 원위부로 분류할 수 있다.1 간문부 담관암과 근위부 담관암은 나쁜 예후와 관련이 있다. 미국에서 매년 발생하는 3000건의 사례 중 절반 이상이 절제 가능하다.
환자는 일반적으로 복통, 가려움증, 체중 감소 및 황달이 있다. 전산화 단층 촬영(CT), 자기 공명 영상 및 초음파는 암을 진단하고 담즙 병변을 특징 짓는데 사용된다. 치료는 수술, 방사선 요법, 화학 요법 및 광역학 요법으로 구성된다. 표준 치료법은 간 외 담관 절제술, 간 절제술 및 외음부 림프절 절제술로 수술 외과적 절제술로 구성된다.2
Patient With Unresectable Cholangiocarcinoma Treated With Radiofrequency Hyperthermia in Combination With Chemotherapy: A Case R
Hyperthermia, which is a noninvasive treatment that causes tumor cells to become heated and that works in synergy with anticancer drugs and radiation therapy, i...
journals.sagepub.com
간문부 담관암은 현재로서는 암의 완전 절제가 가장 효과적이면서 유일한 잠재적 치료 요법이며, 동반 간 절제술이 대부분의 경우에 필요하다는 것은 분명하다.3 그러나, 완전한 절제는 림프선, 관 벽에 있는 상피의 확산, 인접한 간 동맥 또는 간 문맥의 직접적인 침범으로 인해 발생하는 국소적 확장 때문에 때때로 어렵다.4 비소 세포 성 간외 담관 암종은 예후가 좋지 않으며 6개월에서 1년 정도의 평균 기대수명을 보인다.5
Patient With Unresectable Cholangiocarcinoma Treated With Radiofrequency Hyperthermia in Combination With Chemotherapy: A Case R
Hyperthermia, which is a noninvasive treatment that causes tumor cells to become heated and that works in synergy with anticancer drugs and radiation therapy, i...
journals.sagepub.com
종양학에서, 고주파온열치료라는 용어는 열을 투여하고 전자 유도를 생성함으로써 악성 질환을 치료하는 것을 의미한다. 고열은 대개 이미 확립된 치료 양식(방사선 요법 및 화학 요법)의 부수적인 요법으로 적용되며 종양 세포6 를 죽이고 종양 면역 원성의 증가에 영향을 준다.7 본 연구는 절제가 불가능한 간문부 담관암에 대해 동시에 고주파온열치료와 화학 요법을 받은 환자를 보고한다.
증례보고
이 사례 연구는 대전대학교 천안한방병원(심사 번호 : DJUMC-P-2017-02)의 기관 검토위원회의 승인을 받았다.
54세의 남자는 2016년 6월에 서울대학교 병원에서 간문부 담관암(담관종양) 진단을 받고, 경피경간 담도 배액술을 받았다. 그는 7월부터 8월에 수술을 시행하기 위하여 화학 요법으로 선행시술과 수술전시술로 28일간 2사이클의 방사선 치료를 받았다. 환자는 6주 동안 21일 사이클의 첫 번째와 여덟 번째 날에 시스플라틴 25mg + 젬시타빈 1000mg을 투여 받았다.
불행하게도 종양은 화학적 요법을 시행한 방사선요법에 반응하지 않았고 환자는 절제수술이 불가능하다고 진단 받았다. 피로, 소화 불량, 상복부 통증 및 황달을 앓은 환자는 2016년 7월에 대전대학교 천안한방병원을 방문하여 두 번째 치료법을 시행했다. 환자가 방문했을 때, 그의 ECOG(Eastern Cooperative oncology Group의 부작용 및 반응 기준)8 등급은 3점이었다. 2차 요법으로 화학 요법(시스플라틴/젬시타빈)과 병용한 고주파온열치료는 2016년 9월부터 12월까지 총 32회 시행되었다.
REMISSION 1℃ 기기(아디포랩스 제조)를 이용하여 고주파온열치료를 시술하였다. 직경 12cm의 전극 2개를 서로 대향시켜서 0.46MHz의 고주파를 적용했다. 우리는 환자에게 70분 동안 열을 가했고 표면 온도(39℃~41℃)를 지속적으로 측정했다. 환자의 내성에 따라 적용된 전력이 50W에서 100W로 점차 증가되었다.
환자에게 중대한 합병증 없이 고주파온열치료가 32회 실시되었다. 치료 중 탄수화물 항원 19-9(CA 19-9)와 총 빌리루빈 수치가 감소했다(그림 1 및 2). 환자의 ECOG8 등급은 3점에서 2점으로 개선되었다. 피로, 소화 불량, 상복부 통증 및 황달 등 여러 증상이 감소했다.
국립 암 연구소 부작용에 대한 공통 용어 기준(NCI-CTCAE) 4.0 버전에 따르면 피로감은 3등급에서 1등급으로 개선되고 소화 불량은 2등급에서 1등급으로 개선되었다. 고온 요법과 화학 요법 병용 중 종양의 크기를 CT 스캔을 이용하여 측정하였고, 종양에 어떤 진행도 관찰되지 않았다(그림 3). 이와 같이 우리는 고체 종양의 반응 평가 기준(RECIST) 버전 1.1에 따라 질병이 안정되는 것을 확인했다.10
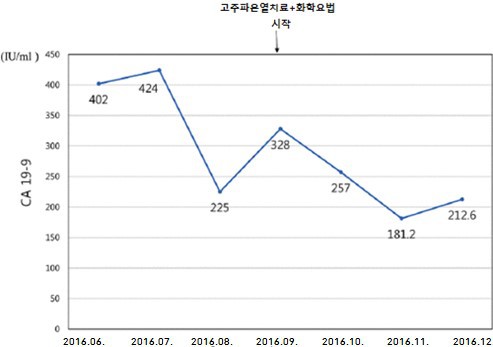
그림 1. 시간에 따른 탄수화물 항원 19-9(CA 19-9) 수준의 변화. 화학 요법을 시행한 선행 및 수술전 방사선 치료 후 CA 19-9 등급은 초기 평가시보다 현저히 낮았지만 다시 증가하기 시작했다. 화학 요법과 병용한 고열치료는 CA19-9의 수준을 328에서 212.6으로 다시 감소시켰다.

그림 2. 시간에 따른 혈청 총 빌리루빈 수치의 변화. 경피 경간 담즙 배액 후 혈청 빌리루빈 수치는 상당히 낮아졌으며 낮아진 빌리루빈 수치는 화학 요법과 고주파온열치료 병용 때에도 비교적 동일하게 유지되었다

그림 3. CT 스캔 이미지. 화학 요법과 고주파온열치료 병용 치료 중 종양의 크기는 9월(A), 11월(B), 12월(C) 2016년 CT 스캔을 사용하여 측정되었다. 종양의 진행은 관찰되지 않았다.
토론
담관암은 담즙 트리 내의 어느 곳에서나 발생할 수 있지만, 담즙성 합병증(담관종양)과 관련된 종양이 가장 일반적입니다.11 담관암은 모든 위장 종양 중에서 3%를 차지합니다. 지난 30년 동안 담관암의 전체 발병률은 증가한 것처럼 보입니다.12 진단 후 5년 생존한 환자의 비율은 이 기간 동안 증가하지 않고 10%를 유지했다.13
Patient With Unresectable Cholangiocarcinoma Treated With Radiofrequency Hyperthermia in Combination With Chemotherapy: A Case R
Hyperthermia, which is a noninvasive treatment that causes tumor cells to become heated and that works in synergy with anticancer drugs and radiation therapy, i...
journals.sagepub.com
지난 30년 동안 발표된 여러 연구에서, 간문부 담관암을 가진 환자의 비율은 40%에서 60%로 상당히 일정하게 유지되었으며, 나머지 종양은 간내 또는 원위부 담관에서 발생했습니다.11 전통적인 치료법으로서 절제술이 잘 확립되어 있지만, 조기 전이가 발견될 수 있으며, 해당 경우에 발견 시점에서 종양 제거 수술은 1/3 이하로 수행된다.12 절제 불가능한 담도암 환자의 대다수는 진단 후 12개월 이내에 사망하며, 보통 간 기능 장애 또는 담도 폐쇄에 따른 감염성 합병증으로 사망한다. 그 예후는 말초 신경 병변보다는 담도 합병증과 관련된 병변에 더 나쁜 것으로 간주되어왔다. 11
고주파온열치료는 의학적 목적으로 국소적으로나 세계적으로 체온을 올리는 과정이다. 고주파온열치료는 정상 세포에 영향을 주지 않고 종양 세포를 죽이거나 약화시킬 수 있다. 종양 세포는 혼란스럽고 작은 혈관 구조를 가지고 있어 열을 발산시키는 데 어려움이 있다. 따라서 고주파온열치료는 가해지는 열에 직접 반응하여 암세포가 사멸하게하고 건강한 조직은 정상 온도를 더 쉽게 유지할 수 있게 한다.
비록 암세포가 완전히 죽지는 않더라도, 이온화방사선 요법이나 특정 화학 요법 약물에 더 민감해질 수 있으며, 이로 인해 그러한 요법이 더 적은 용량으로 효과를 발휘할 수 있다.6 고주파온열치료는 전자 유도를 생성하고 선택적으로 세포막에 에너지를 축적하여 세포 사멸을 보다 효율적으로 발생시킨다.14, 15 또한, 고열은 항성성 항종양의 생성에 영향을 미치고, 유체의 면역성 증가로 인한 종양 면역 증가에 영향을 미치고 면역성 세포 사멸을 초래한다.7
고주파온열치료는 단일 암 치료법으로는 거의 사용되지 않으며 방사선 요법, 화학 요법 또는 방사선 화학 요법, 그리고 최근에는 유전자 및 면역 요법에까지 추가적으로 사용되고 있다. 고주파온열치료에 대한 많은 연구가 종양학 분야에서 지속적으로 수행되고 있다.16-18 담관암에 관해서는, 화학 방사선 요법과 병행하여 8MHz로 국소 고열 치료를 한 8명의 환자 사례가 국소 제어와 장기 생존을 증가시키는 유망한 치료로 보고된 바 있다.19 주파수가 높을수록 감쇄가 커지고 침투깊이가 얕아진다.20
Patient With Unresectable Cholangiocarcinoma Treated With Radiofrequency Hyperthermia in Combination With Chemotherapy: A Case R
Hyperthermia, which is a noninvasive treatment that causes tumor cells to become heated and that works in synergy with anticancer drugs and radiation therapy, i...
journals.sagepub.com
REMISSION 1℃ 장치의 주파수는 0.46MHz로, 고주파온열암치료기 중 가장 낮은 주파수를 사용하고 있다. 이전에 재발 간세포 암으로 고통 받는 환자에 대해 REMISSION 1℃ 장치와 소라페닙을 병용한 사례 연구에서 좋은 결과를 보인 바 있다.21 이 사례에서도 고주파온열암치료 REMISSION 1℃ 기기를 사용하여 연구를 수행하였고, 화학 요법(시스플라틴/겜시타빈)과 결합시켰다.
본 증례보고는 절제 불가능한 간외 담관암 환자의 치료를 위한 고주파온열치료와 화학 요법의 병용요법을 보여주고 있다. 치료 후 CA 19-9와 총 빌리루빈 수치가 낮아졌다. 병용치료로 환자의 증상, 피로, 소화 불량, 상복부 통증 및 황달이 완화되었다. NCI-CTCAE 버전 4.09으로 판단하면 3등급에서 1등급으로 피로가 개선되고 소화 불량이 2등급에서 1등급으로 개선되었다.
또한 환자는 치료 중 심각한 합병증을 경험하지 않고 양호한 상태를 유지했다. 시스플라틴/겜시타빈 조합에서 관찰되는 일반적인 부작용은 발열성 호중구 감소증, 출혈, 식욕 부진, 메스꺼움, 피로 및 백혈구 수 감소 등이다.22
Patient With Unresectable Cholangiocarcinoma Treated With Radiofrequency Hyperthermia in Combination With Chemotherapy: A Case R
Hyperthermia, which is a noninvasive treatment that causes tumor cells to become heated and that works in synergy with anticancer drugs and radiation therapy, i...
journals.sagepub.com
국립암연구소 부작용에 대한 공통 용어 기준(NCI-CTCAE) 버전 4.09으로 판단할 때, 심각한 부작용은 관찰되지 않았다. 환자는 열성 호중구 감소증이나 출혈을 앓지 않았다. 백혈구 수는 정상 범위를 유지했다. 거식증, 메스꺼움 및 피로가 개선되었다. 환자의 ECOG8 등급은 3등급에서 2등급으로 개선되었다. RECIST 버전 1.1에 따르면 CT 스캔 결과는 개선되지 않았지만 질병의 진행을 나타내지는 않았다.10
국소부위의 고열 치료에 대한 임상 연구의 질을 보장하기 위해서는 목표위치와 목표위치 주위의 온도를 기록해야 한다.23 본 연구에서 사용한 REMISSION 1℃ 기기는 이 부분에서는 한계점이 있다.
이러한 결과를 바탕으로, 고열은 적어도 부분적으로 환자가 양호한 상태로 유지되는 것과 화학 요법의 감소된 부작용에 기여한 것으로 생각된다. 본 증례보고는 화학 요법과 병용한 고주파온열치료가 절제 불가능한 담관암 환자 치료의 한 방법일 수 있음을 시사한다.
분쟁 중재 선언
저자(들)는 이 논문의 연구, 저자 및 간행물과 관련하여 어떠한 잠재적인 이해 갈등도 일으키지 않았다.
자금 지원
저자는 이 논문의 연구, 저자 및 출판에 대한 다음과 같은 재정 지원 영수증을 공개했다 : 이 연구는 대전대학교 산학 협력단체인 아디포랩스의 연구비(2016)로 지원되었다.
참고 문헌
|
1. |
Nakeeb A, Pitt HA, Sohn TA, . Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors. Ann Surg. 1996;224:463-475. Google Scholar CrossRef, Medline |
|
2. |
Soares KC, Kamel I, Cosgrove DP, Herman JM, Pawlik TM. Hilar cholangiocarcinoma: diagnosis, treatment options, and management. Hepatobiliary Surg Nutr. 2014;3:18-34. Google Scholar Medline |
|
3. |
Schule S, Altendorf-Hofmann AK, Knösel T, Uteß F, Settmacher U. Diagnostic procedures and results in surgical therapy for cholangiocarcinoma [in German]. Zentralbl Chir. 2014;139(suppl 2):e25-e34. Google Scholar Medline |
|
4. |
Sakamoto E, Nimura Y, Hayakawa N, . The pattern of infiltration at the proximal border of hilar bile duct carcinoma: a histologic analysis of 62 resected cases. Ann Surg. 1998;227:405-411. Google Scholar CrossRef, Medline |
|
5. |
Radtke A, Königsrainer A. Surgical therapy of cholangiocarcinoma. Visc Med. 2016;32:422-426. Google Scholar CrossRef, Medline |
|
6. |
Hegyi G, Szigeti GP, Szász A. Hyperthermia versus oncothermia: cellular effects in complementary cancer therapy. Evid Based Complement Alternat Med. 2013;2013:672873. Google Scholar CrossRef, Medline |
|
7. |
Garg AD, Galluzzi L, Apetoh L, . Molecular and translational classifications of DAMPs in immunogenic cell death. Front Immunol. 2015;6:588. Google Scholar CrossRef, Medline |
|
8. |
Oken MM, Creech RH, Tormey DC, . Toxicity and response criteria of the Eastern Cooperative oncology Group. Am J Clin oncol. 1982;5:649-656. Google Scholar CrossRef, Medline |
|
9. |
National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE) v.4 data files. http://evs.nci.nih.gov/ftp1/CTCAE/About.html. Accessed July 10, 2017. |
|
10. |
Eisenhauer EA, Therasse P, Bogaerts J, . New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45:228-247. Google Scholar CrossRef, Medline |
|
11. |
Jarnagin W, Winston C. Hilar cholangiocarcinoma: diagnosis and staging. HPB (Oxford). 2005;7:244-251. Google Scholar CrossRef, Medline |
|
12. |
Khan SA, Davidson BR, Goldin RD, . Guidelines for the diagnosis and treatment of cholangiocarcinoma: an update. Gut. 2012;61:1657-1669. Google Scholar CrossRef, Medline |
|
13. |
Everhart JE, Ruhl CE. Burden of digestive diseases in the United States part III: liver, biliary tract, and pancreas. Gastroenterology. 2009;136:1134-1144. Google Scholar CrossRef, Medline |
|
14. |
Andocs G, Rehman MU, Zhao QL, Tabuchi Y, Kanamori M, Kondo T. Comparison of biological effects of modulated electro-hyperthermia and conventional heat treatment in human lymphoma U937 cells. Cell Death Discov. 2016;2:16039. Google Scholar CrossRef, Medline |
|
15. |
Yang KL, Huang CC, Chi MS, . In vitro comparison of conventional hyperthermia and modulated electro-hyperthermia. oncotarget. 2016;7:84082-84092. Google Scholar Medline |
|
16. |
Desiderio J, Chao J, Melstrom L, . The 30-year experience—a meta-analysis of randomised and high-quality non-randomised studies of hyperthermic intraperitoneal chemotherapy in the treatment of gastric cancer. Eur J Cancer. 2017;79:1-14. Google Scholar CrossRef, Medline |
|
17. |
Bakrin N, Classe JM, Pomel C, Gouy S, Chene G, Glehen O. Hyperthermic intraperitoneal chemotherapy (HIPEC) in ovarian cancer. J Visc Surg. 2014;151:347-353. Google Scholar CrossRef, Medline |
|
18. |
Toraya-Brown S, Fiering S. Local tumour hyperthermia as immunotherapy for metastatic cancer. Int J Hyperthermia. 2014;30:531-539. Google Scholar CrossRef, Medline |
|
19. |
Kamisawa T, Tu Y, Egawa N, . Thermo-chemo-radiotherapy for advanced bile duct carcinoma. World J Gastroenterol. 2005;11:4206-4209. Google Scholar CrossRef, Medline |
|
20. |
Sadick NS, Makino Y. Selective electro-thermolysis in aesthetic medicine: a review. Lasers Surg Med. 2004;34:91-97. Google Scholar CrossRef, Medline |
|
21. |
Kim JH, Lee JH, Joo JC, Lee JB, Cho CK, Yoo HS. A case report of recurred hepatocellular carcinoma patient treated with radio-frequency hyperthermia in conjunction with sorafenib. J Korean Tradit oncol. 2016;21:63-74. Google Scholar |
|
22. |
Okusaka T, Nakachi K, Fukutomi A, . Gemcitabine alone or in combination with cisplatin in patients with biliary tract cancer: a comparative multicentre study in Japan. Br J Cancer. 2010;103:469-474. Google Scholar CrossRef, Medline |
|
23. |
Bruggmoser G, Bauchowitz S, Canters R, . Quality assurance for clinical studies in regional deep hyperthermia. Strahlenther onkol. 2011;187:605-610. Google Scholar CrossRef, Medline |
자료출처: 아디포랩스
'통합의학' 카테고리의 다른 글
| [이승남의 건강제안] 암 치료 돕는 면역치료부터 식단까지… (0) | 2021.03.22 |
|---|---|
| "면역 요법, 수술-항암 치료 보완... 빠를수록 암 환자에게 도움" (0) | 2021.03.15 |
| 전립선암 전이에 주요 역할을 하는 염증 (0) | 2021.03.06 |
| 가족을 대학병원에서 치료하다 보냈는데 대학병원을 원망하는가? (0) | 2021.03.06 |
| 동맥내 항암치료란 무엇인가? (0) | 2021.03.06 |
